SOLUCIONES:
Introducción
Todos estamos en contacto diario con las soluciones químicas (jugos, refrescos, café, río, mar, et.). Y las plantas también, cuando sus raíces contactan la solución del suelo.
Cuando se introduce un poquito de azúcar dentro de un vaso lleno de agua,
se observa que la azúcar desaparece sin dejar rastro de su presencia en
el agua. Lo primero que se piensa es que hubo una combinación química,
es decir, que las dos sustancias reaccionaron químicamente, lo que
significa que hubo un re acomodo entre sus átomos. Sin embargo,
simplemente sucedió que ambas sustancias se combinaron físicamente y
formaron una mezcla homogénea o solución.
A la unión de dos o más sustancias se le conoce como combinación; estas
combinaciones pue- den ser de dos tipos: combinaciones físicas y
combinaciones químicas. Las combinaciones químicas se conocen como enlaces químicos;
estas combinaciones consisten en la unión de dos o más sustancias,
cuyos átomos o moléculas se unen entre sí mediante fuerzas llamadas
enlaces químico y sólo mediante procedimientos químicos
es posible separar tales sustancias combinadas; por ejemplo, al
combinar agua (H2O) con cal viva (CaO), entonces se forma el Hidróxido
de Cal cio. Aquí hubo una combinación química, puesto que los átomos del
agua y la cal se re acomodaron originando así el Hidróxido de Calcio.
Las combinaciones físicas se conocen como mezclas, las que son de dos tipos: heterogéneas y homogéneas. En las mezclas heterogéneas,
las sustancias que se mezclan no se distribuyen uniformemente, por lo
que se pueden distinguir ambas sustancias mezcladas; en las mezclas
homogéneas, las sustancias mezcladas si se distribuyen uniformemente, y
toda la mezcla se observa como si fuese una sola sustancia, es decir,
las sustancias no se pueden distinguir una de la otra, pues han formado
una sola fase(homogénea). Un ejemplo lo constituyen los perfumes, que
con- tienen agua, alcohol y esencia, y sin embargo ninguna de las tres sustancias puede distinguirse;
a este tipo de mezclas se les denomina disoluciones* o simplemente soluciones.
Un ejemplo claro de solución es el agua salada, que contiene agua y sal.
Tales sustancias se encuentran mezcladas o revueltas homogéneamente, de
tal forma que no se puede distinguir u- na de la otra, y sin embargo no
existe algún enlace químico entre ambas; simplemente el agua disolvió a la sal de mesa, por lo cual se dice que las mezclas son combinaciones que pueden fraccionarse o separarse en sus distintos componentes por métodos físicos.
Concepto de solución

Una solución es una mezcla homogénea de dos o más sustancias. Estas sustancias pueden ser sólidas, líquidas y gaseosas.
Las soluciones, también llamadas disoluciones, son uniones
físicas entre dos o más sustancias que originan una mezcla de tipo
homogénea, la que presenta uniformidad en todas sus partes.
Importancia de las soluciones
- La materia se presenta con mayor frecuencia en la naturaleza en forma de soluciones, dentro de las cuales se llevan a cabo la gran mayoría de los procesos químicos.
- Muchas de estas mezclas son soluciones y todas ellas rodean a los seres vivos (agua de mar, de río, suelo, aire,
sustancias comerciales, etc.), por lo que nuestra existencia depende de
las mismas, en menor o mayor grado. Además, en el interior de una persona existen soluciones tales como la saliva, sangre, orina, ácidos y bases diluidos, etc.
- La industria genera infinidad de soluciones en forma de drogas, medicinas, desinfectantes, bebidas gaseosas, cosméticos, etc.

Partes de una solución (componentes)

Hay dos aspectos importantes en el tema de las soluciones: el de las
partes o sustancias que las forman y el de la cantidad de cada una de
estas partes, principalmente el soluto. Veremos el primer aspecto.
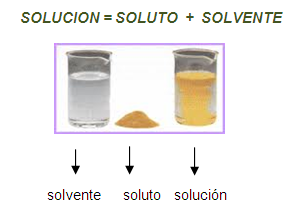
Toda solución está formada por dos partes: el soluto y el solvente. El
soluto es la sustancia que se disuelve y que está en menor cantidad en
una solución; el solvente es la sustancia que se encuentra en mayor
cantidad y es la que di - suelve al soluto. La solución resulta de
mezclar el soluto con el solvente, y estas sustancias mezcladas tan solo
experimentan un cambio físico, específica -mente el solvente (aspecto, puntos defusión, ebullición y congelación, etc.).
En ocasiones, existe un solvente y varios solutos, y a veces varios
solventes y solutos; las partículas del soluto son moléculas o iones y
se encuentran dispersas y atrapadas por las moléculas del solvente, que
son más abundantes y de mayor tamaño molecular.

Con respecto al solvente, se reconoce al agua como el solvente universal
o más popular; cuando el agua actúa como solvente en las soluciones,
entonces estas se denominan "soluciones acuosas".Sin embargo, no todas
las sustancias se disuelven en el agua, sino que lo hacen en otros tipos
de solventes (alcohol, etc.), por lo que las soluciones pueden ser
acuosas (cuando el agua es el solvente) y no-acuosas (cuando el solvente
es otra sustancia).
Estados de las soluciones
Se sabe que toda la materia del mundo se presenta fundamentalmente en 3
estados físicos o de agregación, y en igual modo se presentan las
soluciones en la naturaleza, así:
a. Soluciones sólidas. Todas las aleaciones, como el latón (cobre con zinc), bronce (cobre con es
b. Soluciones líquidas. Como
- Sólido en líquido: sal disuelta en agua; azúcar disuelta en agua, etc.
- Líquido en líquido: alcohol disuelto en agua, etc.
c. Soluciones gaseosas. Como el aire, que es una solución formada por varios gases (solutos), ta
les como el dióxido de carbono, oxígeno y argón, los cuales están disueltos en otro gas llama –
do nitrógeno (solvente). Otros ejemplos son la niebla y el humo.
Así, las soluciones pueden ser sólidas, liquidas y gaseosas, y estar
formadas por gases (soluto) en gases (solvente), gases en líquidos,
sólidos en líquidos, líquidos en líquidos y sólidos en sólidos. Esto es
que, el soluto puede ser un gas, un líquido o un sólido, e igual el
solvente.
Estados de las soluciones
Estado del
Solvente
|
Estado del
Soluto
|
Solución que
Resulta
|
Ejemplos
| |
Solido
|
Solido
|
Solido
|
Aleaciones: bronce, latón, acero.
| |
Liquido
|
Liquido
|
Liquida
|
Alcohol en agua; vino; vinagre.
| |
Liquido
|
Solido
|
Liquida
|
Sal en agua; azúcar en agua.
| |
Liquido
|
Gas
|
Liquida
|
Oxigeno en agua.
| |
Gas
|
Gas
|
Gas
|
Aire.
| |
Propiedades de las soluciones
Las soluciones son materia y por lo tanto tienen propiedades, las cuales
dependen principalmente de la cantidad de soluto presente en la
solución. Estas propiedades reciben el nombre de "propiedades
coligativas", entre las cuales están:
- La composición química de la solución es variable.
- Las propiedades químicas del soluto y del solvente no se alteran cuando se mezclan para for-
mar la solución.
- Las propiedades físicas de la solución si se alteran, principalmente las del solvente, como por
ejemplo el punto de ebullición (aumenta) y el punto de congelación (disminuye).
El agua de mar y el agua azucarada logran hervir a temperaturas mayores que la del agua, o
sea a mas de 100 oC; y estas mismas soluciones logran congelarse a temperaturas más bajas
que la del agua, es decir, menores que O oC .
Solubilidad
La solubilidad es un término que relaciona a las partes de una solución,
y se refiere a la capa- cidad que tiene una sustancia (soluto) para
disolverse en otra (solvente). El grado de solubilidad mide la capacidad
de un soluto para disolverse en un solvente.
Existen solutos que se disuelven muy bien en el agua (sal de mesa,
azúcar, etc.), por lo que su solubilidad es alta; sin embargo, sucede lo
contrario con otros, que casi no se disuelven en agua (soda, etc.),
siendo su solubilidad baja. Un soluto se disuelve mucho mejor cuando:
- La temperatura aumenta.
- La cantidad de soluto a disolver es adecuada.
- El tamaño de las partículas es fino.
Respecto a la cantidad del soluto, algunos líquidos, como el agua y el
alcohol, tienen la capaci dad de disolverse entre ellos mismos y en
cualquier proporción. En una solución de sal y agua, puede suceder que,
si se sigue agregando sal, se llegue a un punto en el que el agua ya no
disolve rá más sal, pues la solución estará saturada; esto es, se llega a
un punto en que el soluto ya no se disuelve en el solvente, dicho a la
inversa, el solvente llega al punto en el que no tiene más capa cidad
para disolver más soluto. Si a un vaso con agua se le agrega y se le
agrega azúcar, el solven te (agua) llegara a un punto en que admitirá
más azúcar pero no la disolverá; el exceso de soluto (azúcar) buscara el
fondo del recipiente, y cuando esto sucede indica que la solución esta
satu- rada.
Un mismo soluto muestra varios grados de solubilidad, según sea el tipo de solvente, tempera- tura y presión;
también se afirma que las sustancias que actúan como solutos no se
disuelven en igual medida en un mismo disolvente. En la mayor parte de
los casos, la solubilidad aumenta al aumentar la temperatura, y en
otros, la solubilidad disminuye al aumentar la temperatura; tam-bien la
solubilidad aumenta o disminuye según sea la clase de
soluto, por ejemplo, la sal de coci - na, el azúcar y el vinagre son
muy solubles en agua, pero no así el bicarbonato de sodio.
Tipos de soluciones (concentración de las soluciones)
Las soluciones se pueden clasificar de dos maneras: según la cantidad de
soluto presente en la solución (concentración), y según el tamaño o
diámetro de las partículas del soluto (suspensiones, soluciones
coloidales y soluciones verdaderas). Las soluciones varían entre sí por
su concentración, y una misma clase de solución puede pre sentar
diferentes tipos de concentraciones; por ejemplo, si se tienen tres
vasos llenos de agua y al primero se le agrega una cucharada de azúcar,
al segundo tres cucharadas y al último seis, en- tonces se está ante una
misma clase de solución (agua azucarada) y tres diferentes tipos de
concentración. En base a la cantidad de soluto presente en las
soluciones, estas se clasifican en:
a. Solución diluida o instaurada. Es aquella en la que existe mucho menos soluto y mucho más solvente.
b. Solución saturada. Es aquella que contiene
la máxima cantidad de soluto que el solvente puede diluir o deshacer,
por lo tanto, cualquier cantidad de soluto que se añada no se disolverá;
la solución sigue teniendo menos soluto y más solvente.
c. Solución sobre-saturada. Las cantidades
extras de soluto agregadas a la solución saturada ya no se disuelven,
por lo que se dirigen hacia el fondo del recipiente (precipitado). Hay
exceso de soluto, pero siempre hay más solvente.
d. Solución concentrada. Es aquella cuya cantidad de soluto es mayor que la del solvente.

Formas de expresar la concentración
- Concepto de concentración.
Este término es uno de los más importantes en el tema de las
soluciones, y se refiere a las cantidades o proporciones tanto del
soluto como del solvente. De manera simple, la concentración de una
solución se define como
"la cantidad de soluto que hay en una solución "
Las cantidades del soluto y del solvente se pueden relacionar entre sí,
con el propósito de establecer la proporción en que se encuentran ambos
dentro de una solución; en otras palabras, en una solución habrá una
cierta cantidad de soluto disuelta por una cierta cantidad de solvente,
lo que se puede calcular mediante el empleo de ciertas formulas sencillas.
- Formas de expresar la concentración. Por lo general, los envases de drogas, medicinas y otros productos muestran
la concentración de la sustancia que contienen. La cantidad de soluto
presente en una determinada cantidad de solvente o solución puede
indicarse o expresarse de diferentes modos, por ejemplo:
a. En partes por millón (ppm), por ejemplo:
* mg/l (miligramos de soluto por litro de solución o muestra).
* mg/kg (miligramos de soluto por kilogramo de solución o muestra).
b. En porcentaje (porcentaje de soluto presente por cada 100 partes de solución)
c. En molar (moles de soluto por litro de solución, o sea molaridad).
d. En molal (moles de soluto por kilogramo de solvente, o sea molalidad).
e. En equivalente-gramo por litro (Normalidad).
f. Otros.
Se observa que para expresar la concentración de las soluciones
se emplean unidades de me- dida físicas (gramos, miligramos, litros y
mililitros), y unidades de medida químicas (mol, molal y equivalente
gramo).
Cálculo de la concentración de las soluciones
Toda persona interesada en calcular la concentración de una solución, es
decir, la cantidad o proporción de soluto presente en una solución,
puede auxiliarse de cualquiera de los tres méto- dos existentes para
ello; en todo caso, la concentración que se calcula corresponde al de
las soluciones diluidas y saturadas. He aquí los métodos.
- Método empírico o visual. Consiste en apreciar
detenidamente la solución, y establecer un criterio sobre la presencia o
aparente ausencia de soluto en la misma; seguidamente este criterio se
compara con la definición correspondiente a cada tipo fundamental de
solución(solución diluida, saturada, etc.) , y a continuación se
establece definitivamente ante qué tipo de solución se está. Este método es cualitativo, y no es preciso en la determinación de la concentración de una solución, pues se basa en un criterio personal, y no en formula o calculo alguno.
Por ejemplo: si se aprecia una solución y no se observan partículas de soluto, entonces se esta ante una solución del tipo diluida o instaurada;
pero si se observan algunas partículas en el fondo del recipiente que
contiene a la solución en estudio, luego la solución es tipo saturada; y si en el fondo del mismo recipiente se observa una capa de soluto, entonces la solución esta sobresaturada. Por último, sí en tal recipiente existiese más soluto que solvente, definitivamente que la solución sería del tipo concentrada.
- Métodos físicos. Son sencillos, y nombrados así porque
son expresiones o fórmulas que contienen unidades de medidas físicas
(gramos, miligramos, etc.). Son métodos cuantitativos, y por lo tanto
expresan la concentración con precisión, e indican en porcentaje (%) la
cantidad de masa del soluto presente por cada cien partes de masa de la
solución. Son 3 estos métodos:

Esta fórmula o expresión se utiliza cuando la masa del soluto, solvente o
solución esta expresada en gramos; el peso del soluto (masa) se divide
entre el peso de la solución( peso sobre peso), y este resultado parcial
se multiplica por cien para obtener el resultado final, el que indica
el peso del soluto por cada cien unidades de peso de de la solución.
Ejercicio 1.
¿Cuál es la concentración de la sal de mesa o cloruro de sodio (NaCl) en una solución formada por 50 gramos de agua (solvente) y 5 gramos de esta sal (soluto) ?
La sal de mesa representa al soluto y el agua al solvente; cuando ambas
cantidades se suman, luego resulta la masa de la solución (agua salada).
Primer paso. Reunir los valores numéricos.
- Masa del soluto = 5 gramos.
- Masa del solvente = 45 gramos.
- Masa de la solución = 50 gramos.
Segundo paso. Aplicar la expresión o formula física de % de peso sobre peso (% p/p).

Respuesta= La concentración de la sal de cocina en la solución de agua
salada es de 10%; esto significa que la solución está formada por 90
partes de solvente (agua) y 10 partes de soluto (sal de cocina), o bien,
que existen 10 gramos de sal por cada 100 gramos de solución.
Ejercicio 2.
Una solución de agua azucarada pesa 120 gramos, y contiene 30 gramos de
azúcar de mesa o sacarosa ( C12H22O11). ¿ Cuál es la concentración del
azúcar?
El azúcar de mesa representa al soluto, la que ha sido disuelta en agua
(solvente), formandose así la solución de agua azucarada.
Primer paso. Reunir los valores numéricos.
- Masa del soluto = 30 gramos.
- Masa de la solución = 120 gramos.
Segundo paso. Aplicar la expresión o formula física de % de peso sobre peso (% p/p).

Respuesta= La concentración del azúcar en la solución de agua azucarada
es de 25 %; en otras palabras, el azúcar representa el 25 % de la
solución.

Esta fórmula o expresión se utiliza cuando la masa del soluto esta
expresada en gramos y la masa del solvente o solución están expresadas
en mililitros; en otras palabras, la expresión se utiliza cuando el
soluto es un sólido y el solvente o solución es un líquido. La masa del
soluto se dividen entre el volumen o
mililitros de la solución ( peso sobre volumen), y este resultado se
multiplica por cien para obtener el resultado final, el que indica el
peso en gramos del soluto que hay por cada cien mililitros de solución, o
sea, en qué porcentaje está presente el soluto en comparación con toda
la solución(100%).
Ejercicio 1.
¿Cuál es la concentración, o porcentaje de peso sobre volumen (%P/V) ,
de 30 gramos de sal de mesa en una solución de 150 mililitros de agua
salada?
Observe que la masa del soluto (sal) esta expresada en gramos y que la
solución(agua salada) esta expresada en unidades de volumen, o sea
mililitros.
Primer paso. Reunir los valores numéricos.
- Masa del soluto (sal) = 30 gramos.
- Volumen de la solución (agua salada) = 150 ml.
Segundo paso. Aplicar la expresión o formula física de % de peso sobre volumen (% P/V).

Respuesta= La concentración de la sal de cocina en la solución de agua
salada es de 20%; esto significa que por cada 100 partes de solución hay
20 partes de sal.
Ejercicio 2.
¿Cuál es la concentración, o porcentaje de peso sobre volumen (%P/V) ,
de 60 gramos de azúcar de mesa en una solución de 150 mililitros de agua
azucarada?
El azúcar de mesa representa al soluto, la que ha sido disuelta en agua
(solvente), formandose así la solución de agua azucarada.
Primer paso. Reunir los valores numéricos.
- Masa del soluto (azúcar) = 60 gramos.
- Volumen de la solución (agua azucarada) = 150 mililitros.
Segundo paso. Aplicar la expresión o formula física de % de peso sobre volumen (% p/v).

Respuesta= La concentración del azúcar en la solución de agua azucarada
es de 40 %; en otras palabras, el azúcar representa el 40 % de la
solución.

Esta expresión se utiliza cuando el soluto, el solvente y la solución
están expresados en mililitros,o sea, en unidades de volumen; las
sustancias involucradas en esta expresión deberían ser liquidas o gases.
Los mililitros de soluto se dividen entre los mililitros de la solución
(volumen sobre volumen), y este resultado se multiplica por cien para
obtener el resultado final, el que indica el volumen de soluto presente
por cada cien unidades de volumen de la solución.
Ejercicio 1.
¿Cuál es la concentración de alcohol en una solución formada por 45 mililitros de agua (solvente) y 5 ml de alcohol (soluto) ?
El alcohol representa al soluto, el que ha sido disuelto en agua (solvente), formándose así la solución de agua alcoholizada.
Primer paso. Reunir los valores numéricos.
- Volumen del soluto = 5 ml de alcohol
- Volumen del solvente = 45 ml de agua
- Volumen de la solución = 50 ml de agua alcoholizada.
Segundo paso. Aplicar la expresión física de % de volumen sobre volumen (% V/V).

Respuesta= La concentración del alcohol en la solución es de 10 % , esto
es, que por cada 100 partes de solución existen 10 partes de alcohol.
Ejercicio 2.
Una solución está formada por 400 ml de Ácido Clorhídrico (HCI) y 1,600
ml de agua ¿Cual es la concentración del ácido en % de volumen sobre
volumen ?
El HCl representa al soluto, el que ha sido disuelto en agua (solvente), formándose así la solución de agua y acido.
Primer paso. Reunir los valores numéricos.
- Volumen del soluto = 400 ml
- Volumen del solvente = 1,600 ml
- Volumen de la solución = 2,000 ml
Segundo paso. Aplicar la expresión física de % de volumen sobre volumen (% v/v).

Respuesta= La concentración del ácido en la solución es de 20 % , o sea,
que por cada 100 partes de solución existen 20 partes de ácido.
PROBLEMAS DE
SOLUCIONES PARA SEGUNDO FISICO-QUIMICA
RESOLVER
1-¿Qué cantidad de sal tengo, si extraigo 160 ml de una
solución al 30 % m/m?
2-¿Cuantos gramos de un producto denominado soluto obtengo,
si extraigo de una solución al 26 % m/m de dicho producto, 450 ml?
3-Si de una solución de azúcar al 23 % m/m se vierten 250
gramos de esta en un frasco ¿Qué masa de la misma tendría en ese frasco?
4-Una solución al 5 % m/m de sal común se encuentra en un
estante y deseo obtener 7 gramos de esta
sal ¿Cuántos gramos de solución tengo que extraer?
5-Se necesitan tener para un medicamento 25 gramos de una
sal que se encuentra dentro de una solución 25 % m/m ¿Qué cantidad de gramos
tengo que extraer de la misma?
6-Cual es el % m/m de 550 gramos de una solución, que se
preparó agregándole a la misma 37 gramos de soluto.
7-Una solución de azúcar en agua se preparó agregando 37
gramos de azúcar y llenándola con agua hasta que pese 755 gramos ¿Calcular el %
m/m de esta solución?
CALCULAR EL % m/m, de las siguientes soluciones:
a-
33 gramos de bicarbonato en 350 gramos de
solución.
b-
27 gramos de sal de mesa en 730 gramos de
solución.
c-
47 gramos de azúcar en 455 gramos de solución.
d-
79 gramos de soda caustica en 965 gramos de
solución.
e-
18 gramos de azúcar negra en 237 gramos de
solución.
CALCULAR LA MASA DE SAL QUE TENGO SI EXTRAIGO 500 gramos de
las siguientes soluciones:
a-
Una solución al 25 % m/m.
b-
Una solución al 38 % m/m.
c-
Una solución al 47 % m/m.
d-
Una solución al 29 % m/m.
e-
Una solución al 53 % m/m.
CAKLCULAR QUE CANTIDAD DE GRAMOS TENGO QUE EXTRAER DE UNA
SOLUCION DE UNA SAL al 37 % m/m para
tener:
a-
26 gramos de sal.
b-
37 gramos de sal.
c-
45 gramos de sal.
d-
87 gramos

No hay comentarios.:
Publicar un comentario