A los alumnos de segundo año de la EES 2 y la EES 9, saludos y buena cursada. En este blog encontrarán todo el material teórico necesario para entender todo lo explicado en clase.
Saludos.
FISICOQUIMICA MEDIA2
domingo, 19 de marzo de 2017
sábado, 18 de marzo de 2017
La teoría cinético-molecular y los estados de agregación de la materia

La teoría cinético-molecular de la materia es una extensión de la teoría cinética de los gases que nos permite explicar el comportamiento de las sustancias en cada uno de los estados, a partir de unos principios o postulados generales que, comúnmente, se resumen de la manera siguiente:
- La materia está formada por entidades muy pequeñas llamadas partículas (átomos o moléculas).
- Las partículas están en continuo movimiento, chocando entre sí de manera elástica.
- Entre las partículas existen interacciones, más o menos intensas dependiendo del estado de agregación.
Estado sólido
En el estado sólido, las partículas están muy próximas y fuertemente unidas entre sí, por lo que mantienen fijas sus posiciones, manteniendo las distancias que hay entre ellas. Es por ello que adoptan estructuras tridimensionales de volumen definido y constante (se consideran incompresibles).No obstante, las partículas poseen un cierto movimiento de vibración, que aumenta con la temperatura, motivo por el cual, al calentarlos, las vibraciones crecen, aumentando el volumen (dilatación), y pueden llegar a vencerse las fuerzas de atracción (cambio de estado).

Estado líquido
En el estado líquido, las distancias entre las partículas son ligeramente mayores que en los sólidos, pero su movimiento y sus interacciones impiden que este espacio se reduzca, por lo que son prácticamente incompresibles. Sin embargo, aunque las interacciones son los suficientemente grandes como para evitar su dispersión, la movilidad que poseen las partículas permite que se desplacen unas respecto a otras, otorgándoles la capacidad de fluir y de amoldarse al recipiente que las contiene.Una característica de los líquidos es que presentan propiedades de superficie, ya que las partículas situadas en el interior experimentan interacciones con las que se encuentran alrededor, a diferencia de las partículas superficiales, que poseen interacciones que no están equilibradas o completamente compensadas. Por ejemplo, los líquidos tienden a presentar la mínima superficie posible, ya que existen una serie de fuerzas en ella que tiran de las partículas hacia el interior, formando gotas (fenómeno que se conoce como tensión superficial).

Estado gaseoso
En los gases, las partículas estás separadas grandes distancias (en comparación con su tamaño) y, en consecuencia, las interacciones entre ellas se consideran nulas. Por ello, los gases adoptan la forma y ocupan el volumen del recipiente que los contienese.Las partículas gaseosas se mueven libre y azarosamente, chocando elásticamente entre sí y con las paredes del recipiente (ejerciendo una determina presión), aumentando la velocidad media y los choques con la temperatura.

|
LOS ESTADOS DE
AGREGACIÓN DE LA MATERIA
|
||||||||||||||||||||||||||||||||||
|
Todo en el Universo está
formado por materia. La materia se puede encontrar en 3 estados de agregación o
estados físicos: sólido, líquido y gaseoso. Sus propiedades
son:
Puedes ver más información en esta
página web.
La teoría cinética
La teoría cinética nos
indica que la materia, sea cual sea su estado, está formada por partículas tan
diminutas que no se pueden observar a simple vista y que, además, se encuentran
en continuo movimiento. Ese estado de movimiento depende de la temperatura,
siendo mayor conforme más alto es el valor de dicha temperatura.
Para comprender mejor la teoría cinética
puedes trabajar con esta
webquest.
Realiza las siguientes
actividades.
Los estados de agregación y la teoría cinética
La teoría cinética es
capaz de explicar porqué una misma sustancia se puede encontrar en los 3
estados: sólido, líquido y gas. Esto depende sólo de la manera de agruparse y
ordenarse las partículas en cada estado.
Estado sólido:
La teoría cinética explica este estado como puede verse en esta
página web y en esta
otra.
Estado líquido: La
teoría cinética explica este estado en esta
página web y en esta
otra.
Estado gaseoso: La
teoría cinética lo explica como puede verse
aquí y en esta
otra página.
La temperatura de los cuerpos y
la teoría cinética
Cuando calentamos un
cuerpo, sus partículas se mueven más deprisa con lo cual aumentan su energía
cinética. Si lo enfriamos ocurre lo contrario: disminuye la energía cinética de
las partículas. La energía cinética es la energía que tiene un cuerpo en
movimiento.
La temperatura es la medida de la
energía térmica (energía cinética media de todas las partículas que forman un
cuerpo) de una sustancia. Se mide con un termómetro. Las escalas más
empleadas para medir esta magnitud son la Escala Celsius (o centígrada) y la
Escala Kelvin. 1ºC es lo mismo que 1 K, la única diferencia es que el 0 en la
escala Kelvin está a - 273 ºC.
En la escala Celsius se asigna el
valor 0 (0 ºC) a la temperatura de congelación del agua y el valor 100 (100 ºC)
a la temperatura de ebullición del agua. El intervalo entre estas dos
temperaturas se divide en 100 partes iguales, cada una de las cuales corresponde
a 1 grado.
En la escala Kelvin se asignó el 0 a
aquella temperatura a la cual las partículas no se mueven (temperatura más baja
posible). Esta temperatura equivale a -273 ºC de la escala Celsius.
Para convertir ambas temperaturas,
tenemos que tener en cuenta que:
T (K) = t(ºC) + 273
En esta página,
Calor y temperatura,
puedes ver lo que es la temperatura y su relación con el calor.
En esta web
Temperatura
puedes ver qué es la temperatura y cómo se mide.
Realiza las siguientes
actividades.
La teoría cinética
explica el estado gaseoso de la siguiente forma:
Los gases tienden a ocupar todo
el volumen disponible
En los gases, las
partículas están muy separadas unas de otras y se mueven libremente a gran
velocidad; por eso ocupan todo el espacio disponible y no tienen volumen ni
forma fijos.
El que las partículas se
encuentren tan separadas da lugar a que los gases sean compresibles y ocupen el
volumen del recipiente que los contiene.
Los gases pueden sufrir
compresión y expansión. Si acercamos las partículas del gas, entonces se
comprime y si las alejamos se expanden.
Los gases ejercen presión
Debido a que las
partículas del gas están en continuo movimiento chocan entre ellas y con las
paredes del recipiente. Estas colisiones son las responsables de la presión
que ejerce el gas.
La presión varía con el volumen
Si la temperatura de un
gas permanece constante:
Esto puedes verlo en la
siguiente
página.
El volumen de los gases varía
con la temperatura
Si la presión a la que se
ve sometido un gas permanece constante:
En esta
página encontrarás información sobre este fenómeno.
La presión y la temperatura
están relacionadas
Si el volumen de un gas
permanece constante:
Puedes estudiar este
fenómeno
aquí.
Realiza las siguientes
actividades.
Un cambio de estado
es el paso de un estado de agregación a otro en una sustancia como consecuencia
de una modificación de la temperatura (o de presión).
Ver página.
Existen varios cambios de
estado, que son:
- Fusión: Es el
paso de una sustancia de sólido a líquido. La temperatura a la que esto ocurre
se llama Temperatura de fusión o punto de fusión de esa sustancia.
Mientras hay sólido convirtiéndose en líquido, la temperatura no cambia, se
mantiene constante. Por ejemplo, en el agua el punto de fusión es 0 ºC; mientras
haya hielo transformándose en agua la temperatura no variará de 0 ºC. Esto
ocurre porque toda la energía se invierte en romper las uniones entre partículas
y no en darles mayor velocidad en ese tramo. Puedes verlo en esta
página.
- Solidificación:
Es el cambio de estado de líquido a sólido. La temperatura a la que ocurre es la
misma: el punto de fusión.
- Vaporización: Es
el cambio de estado de líquido a gas. Se puede producir de 2 formas: evaporación
y ebullición. La evaporación se produce sólo en la superficie del líquido
y a cualquier temperatura, se escapan las partículas más energéticas del
líquido. por el contrario, la ebullición se produce en todo el líquido y
a una temperatura característica llama temperatura o punto de ebullición. por
ejemplo, en el agua es de 100 ºC y se mantiene mientras hay agua pasando a
vapor. En esta
página puedes ver la diferencia entre ambas formas de vaporización.
- Condensación: Es
el cambio de estado de gas a líquido. La temperatura a la que ocurre es el punto
de ebullición.
- Sublimación: Es
el cambio de estado de sólido a gas (sin pasar por el estado líquido). Esto
ocurre, por ejemplo, en sustancias como: alcanfor, naftalina, yodo, etc. Un buen
ejemplo práctico serían los ambientadores sólidos o los antipolillas.
- Sublimación inversa:
Es el cambio de estado de gas a sólido (sin pasar por el estado líquido).
En esta
animación puede verse cómo se producen los cambios de estado y, al mismo
tiempo, qué les ocurre a las partículas de la sustancia.
Los cambios de estado se
suelen representar en unas gráficas llamadas gráficas de calentamiento o
gráficas de enfriamiento que son iguales para todas las sustancias, ya
que sólo varían en su punto de fusión y en su punto de ebullición, que son
propiedades características de cada sustancia. Un ejemplo de estas gráficas se
puede ver en la siguiente
animación, que muestra la gráfica al mismo tiempo que el cambio de estado.
Los puntos de fusión y
de ebullición de las sustancias puras tienen valores constantes y cada sustancia
pura tiene su propio punto de fusión y de ebullición. Por ejemplo, el agua
tiene como punto de fusión 0 ºC y como punto de ebullición 100 ºC (a la presión
del nivel del mar), el alcohol etílico tiene punto de fusión -114 ºC y punto de
ebullición 78 ºC. En la siguiente tabla puedes ver algunos ejemplos:
Los puntos de fusión y de
ebullición se pueden calcular como muestra esta
animación.
Realiza estas
actividades.
Realiza las siguientes
actividades.
La presión atmosférica
es la presión que ejerce la atmósfera debido a su peso sobre la superficie de
los cuerpos que están en contacto con ella.
Puedes aprender más sobre
la presión atmosférica visitando esta
página.
La presión atmosférica se
mide con un instrumento llamado barómetro.
La presión a nivel del
mar es de 1013 mb o 1 atm.
La presión superior a
1013 mb se llama alta presión y, si es menor, baja presión.
En los mapas
meteorológicos se unen puntos con la misma presión mediante unas líneas llamadas
isobaras.
Puedes consultar esta
página para obtener más información sobre los mapas meteorológicos y la
información del tiempo, además puedes hacer actividades para practicar.
| ||||||||||||||||||||||||||||||||||
sábado, 10 de septiembre de 2016
MATERIA: SISTEMAS MATERIALES
Los
sistemas materiales son cuerpos, sustancias, partes de un cuerpo o conjuntos de
cuerpos y sustancias que se encuentran juntos. Son porciones de la naturaleza
material que separamos para estudiar
Estos
sistemas se suelen clasificar a simple vista en dos grandes grupos: HOMOGÉNEOS,
cuando se puede observar una sola fase, es decir que dan la apariencia de estar
formados por un solo componente y las propiedades son las mismas en todos los
puntos del sistema; HETEROGÉNEOS, cuando se observan dos o más fases, aún
cuando estas fases puedan corresponder a diferentes estados de un mismo
componente, y se observan diferentes propiedades en distintos puntos del
sistema.
Se
llama fase a cada parte homogénea en un sistema heterogéneo y componente a
cada una de las sustancias que se encuentran mezcladas en el mismo. La cantidad
de fases y componentes es variada e independiente, es decir un sistema puede
tener tres fases y un solo componente como ocurre con el agua que puede estar en
el mismo sistema en los tres estados o puede tener tres componentes y una sola
fase como ocurre en una mezcla de sal agua y azúcar.
Cada uno de ellos puede subdividirse en distintas clases, Por
ejemplo:
Las sustancias son las distintas clases de
materia que presentan propiedades específicas constantes y una composición
definida. No pueden separarse ni fraccionarse. Son las verdaderas especies
químicas.
Las sustancias simples son las que no
pueden descomponerse en nada más sencillo porque son lo más sencillo que hay;
están formadas por un solo elemento químico. Algunos elementos tienen la
propiedad de formar distintas sustancias simples según la forma de agrupación
de sus átomos, se dice entonces que presentan variedades alotrópicas. Son sustancias simples los metales como el
hierro, cobre, oro, cinc, sodio, etc., y otras no metálicas como el azufre, nitrógeno, cloro, etc. El oxígeno y el ozono son variedades alotrópicas del
oxígeno; el carbón, el grafito y el diamante son variedades alotrópicas del
carbono
Las sustancias compuestas son las que están
compuestas por dos o más elementos y por lo tanto pueden descomponerse en otras
más sencillas. La Ley de las Proporciones Definidas o Constantes, de Joseph
Louis Proust, una de las primeras leyes de la Química, sostiene al respecto que
“Una misma sustancia compuesta tiene
siempre los mismos elementos unidos en la misma proporción de masas”. Hay
sustancias compuestas minerales como la sal común o cloruro de sodio, el yeso o
sulfato de calcio, el dióxido de carbono, el agua. Hay también sustancias
compuestas orgánicas como el azúcar común o sacarosa, el alcohol etílico, el
ácido cítrico, las proteínas, etc.
Las soluciones son las mezclas homogéneas,
es decir sistemas formados por dos o más componentes pero que presentan una
sola fase, ya que las partículas de la fase disuelta son más pequeñas de lo que
puede observar cualquier microscopio (< 0,1 nm). Por esto son claras y transparentes,
no decantan ni filtran y sólo se pueden separar por alguno de los métodos de
fraccionamiento. El componente que determina el estado de la solución o que se
encuentra en mayor proporción es el solvente, y el de menor proporción es el
soluto. Una solución puede tener un solvente y varios solutos o también varios
solventes. Son soluciones naturales por ej. el agua mineral, el agua de mar, el
aire, el azúcar en la sangre, algunos derivados del petróleo, etc.
De acuerdo con el estado de agregación de sus componentes, las soluciones se clasifican:
De acuerdo con el estado de agregación de sus componentes, las soluciones se clasifican:
Solutoà
Solvente↓
|
SÓLIDA
|
LÍQUIDA
|
GASEOSA
|
SÓLIDO
|
BRONCE
|
SAL HÚMEDA
|
ADSORCIONES
|
LÍQUIDO
|
AGUA MINERAL
|
VINAGRE
|
OXÍGENO EN AGUA
|
GAS
|
AROMAS
|
HUMEDAD EN AIRE
|
AIRE
|
El bronce, como todas las aleaciones metálicas, es una disolución de dos metales o más (en este caso estaño y cobre) que se unen tan profundamente que adquieren propiedades especiales sin que pueda considerarse un fenómeno químico.
Las adsorciones son sistemas muy particulares en los que las moléculas de un gas quedan atrapadas en la superficie de las partículas de un sólido. Así atrapan a los gases tóxicos los componentes activos de una máscara antigases por ejemplo.
La gran mayoría de los aromas de flores, frutos y también los desagradables, se deben a moléculas de sustancias sólidas que se dispersan en el aire y así llegan a nuestro membrana olfatoria.
Las emulsiones son sistemas heterogéneos
formados por la mezcla íntima de dos líquidos insolubles. Esto se logra
generalmente mediante la acción de un agente emulsionante. Son emulsiones por
ejemplo muchas cremas usadas en cosmética, la grasa de la leche, la mayonesa,
etc.
Las suspensiones son mezclas que tienen una
fase de partículas finamente divididas pero visibles (>1 µm) en un estado de
agregación y otra fase continua en otro estado de agregación. Por ejemplo: el
agua turbia de un río (sólido en líquido), la neblina (líquido en un gas), la
espuma (gas en un líquido), el humo (sólido en un gas), etc.
Como dispersiones se suele considerar a
todos los sistemas heterogéneos en los que las fases estén mezcladas, pero más
en particular a las mezclas de dos sólidos con partículas fácilmente
observables, como por ejemplo, la tierra,
la arcilla, la arena, etc.
La combinación de dos
elementos o sustancias para formar otra, así como la descomposición de una
sustancia compuesta en otras más sencilla son fenómenos químicos; la separación
de fases, el fraccionamiento, así como la mezcla o disolución son en cambio
fenómenos físicos, ya que las sustancias mezcladas siguen conservando sus
particularidades.
También se pueden
clasificar los sistemas heterogéneos o dispersiones por el estado de agregación
de la fase dispersa, (la que se encuentra en menor proporción) y de la fase
dispersante, (la que está en mayor cantidad).
Fase
Dispersaà
Fase Dispersante↓
|
SÓLIDA
|
LÍQUIDA
|
GASEOSA
|
SÓLIDO
|
HARINA
|
BARRO
|
PIEDRA
POMES
|
LÍQUIDO
|
PINTURA
|
CREMA
|
GASEOSAS
|
GAS
|
HUMO
|
NIEBLA
|
NO
(Todos
los gases son solubles)
|
MÉTODOS
DE SEPARACIÓN DE FASES
Los métodos de separación de fases son
procedimientos físicos y mecánicos destinados a separa las diferentes fases de
una dispersión. En estos procesos las sustancias no se transforman sólo se
separan. El método usado depende de las características de las fases del
sistema. Por ejemplo:
TRÍA: Es una operación manual en la que se
separan fases fácilmente observables de un sistema de pocos componentes sólidos
o de una muestra pequeña del mismo. Por ejemplo las frutas defectuosas de las
sanas en un sector de encajonado.
TAMIZACIÓN: Es un método utilizado para separa
dos fases sólidas con particulado de diferente tamaño mediante un tamiz, criba o
cernidor con perforaciones adecuadas para que deje pasar la fase más pequeña y
retenga la más grande. Así se separan por ejemplo semillas de diferentes
cereales o la arena o la harina.
FILTRACIÓN: Es un método usado para separar un
sólido insoluble de un líquido. Consiste
en hacer pasar la dispersión por un filtro que retiene las partículas sólidas y
deja pasar el líquido. Así se separan por ejemplo las impurezas de la leche en
las plantas de pasteurización. En muchos casos se usan filtros prensa, como en
la extracción de aceites de oliva o girasol
DECANTACIÓN: Es el método usado para separar dos
líquidos no miscibles de diferentes densidades o un sólido insoluble. Consiste
simplemente en dejar el sistema en reposo durante un tiempo de modo que la fase
más densa se deposita en el fondo y la menos densa queda arriba. Así se separan
por ejemplo las impurezas sólidas en los procesos de potabilización de aguas de
río.
FLOTACIÓN: Este método se usa para separa
minerales finamente divididos que tienen diferentes afinidades por un
determinado líquido o gas. Consiste en hacer burbujear un gas en la masa
barrosa que contiene a la dispersión y un agente que genere espuma. La espuma
arrastra hacia la superficie las partículas de una de las fases y deja en el
fondo a las otras. Se utiliza especialmente en la concentración de determinados
minerales livianos como los sulfuros de cobre o de hierro en la industria
metalúrgica.
CENTRIFUGADO: Se utiliza para separar líquidos no
miscibles o un sólido de un líquido. Consiste en someter al sistema a la acción
de una máquina centrífuga que acelera la decantación, enviando la fase más
densa hacia el exterior del círculo de giro mientras que la menos densa queda
en el interior. Así separa la crema de la leche en la industria láctea o algunos
componentes de la sangre en un laboratorio bioquímico.
IMANTACIÓN: Es un método para separar partículas
de hierro de un sistema. Consiste en hacer pasar el sistema (generalmente
sólido) por unas zarandas imantadas o desplazar un imán por la superficie del
sistema de modo que retenga las partículas de hierro. Se utiliza en la limpieza
de cereales que han sido maquinados y arrastran partículas de hierro de las
máquinas de tratamiento o acarreo.
EVAPORACIÓN: Se utiliza para separar un líquido de
un sólido mediante calor o corrientes de aire. Así se seca la ropa tendida, o
las semillas de cereales, o el azúcar separado de la caña, etc.
VENTILACIÓN: Se utiliza para separar sistemas
sólidos con una fase muy liviana que es arrastrada por corrientes de aire. Así
se separan por ejemplo las cáscaras de algunos cereales.
LEVIGACIÓN: Se utiliza para separar sistemas
sólidos con fases de distinto peso mediante una corriente de agua que arrastra
a la fase más liviana. Así se separan las arenas e impureza del oro en la
extracción de este metal.
LIXIVIACIÓN: En algunos aspectos es similar a la
levigación pero el líquido arrastra a uno de los sólidos por disolución. Se
utiliza por ejemplo para separar el azúcar de la remolacha azucarera mediante
una corriente de agua sobre las rodajas finas de la remolacha.
EXTRACCIÓN
O DISOLUCIÓN: Se
utiliza para separa dos sólidos de diferente solubilidad. Se agrega al sistema
un líquido que tenga la propiedad de disolver a uno de los sólidos y no al
otro. Luego se separa la solución del sólido insoluble y por último se evapora
el solvente quedando el sólido soluble aparte. Este método suele recibir
diferentes nombre según la forma de disolución. Por ejemplo: Infusión, cuando
el solvente es agua caliente (como el mate o el té). Decocción, cuando el
solvente es agua que hierve durante un rato (como en el matecocido o en el
caldo de verduras). Maceración, cuando el solvente es alcohol (como en la
elaboración de perfumes y licores).
SUBLIMACIÓN: Se utiliza para separar dos sólidos
volátiles. Al calentar la mezcla, el sólido que volatilice a más baja
temperatura, lo hará primero, luego sus vapores se enfrían y subliman.
FUSIÓN: Se utiliza para separar los
componentes de una mezcla sólida cuando estos no se descomponen por el calor.
Consiste en calentar el sistema hasta que estén todos los componentes fundidos
y luego dejar en reposo para que se enfríe lentamente y los líquidos se
concentren a diferentes alturas. Así se separa el sebo de la grasa vacuna para
refinarla.
MÉTODOS
DE FRACCIONAMIENTO DE SOLUCIONES
Estos Son métodos físicos, que por lo
general se basan en algún cambio de estado o forma de distribución de alguno de
los componentes de la solución. Por ejemplo:
DESTILACIÓN: Usado para fraccionar soluciones de
dos líquidos o de un líquido que se quiere separar de sus sólidos disueltos.
Consiste en someter al sistema a la acción del calor hasta que el componente de
menor punto de ebullición comience a hervir; sus vapores son conducidos a un
refrigerante que los vuelve a condensar. Los dispositivos utilizados para este
proceso reciben el nombre de destiladores o alambiques. Por este proceso se
obtiene el agua destilada y se concentra el alcohol para las bebidas
alcohólicas.
DESTILACIÓN
FRACCIONADA: Es un
método basado en el mismo principio que el anterior pero es más efectivo cuando
el sistema es una solución de varios líquidos de puntos de ebullición cercanos.
Se calienta la solución en una torre de fraccionamiento que suele ser muy alta
y cuenta a distintas alturas con platillos o sistemas de recolección de
lluvias. Los vapores ascienden por la columna pero se van enfriando, se
condensan y caen como lluvia que vuelve a calentarse, evaporarse y subir. Al
cabo de un tiempo la columna entra en régimen, es decir que comienzan a
concentrarse a distintas alturas los vapores de los componentes cuyo punto de
ebullición es cercano a la temperatura de ese lugar y entonces son recogidos
por los platillos o tubos de recolección que los sacan fuera de la columna. Por
este proceso se destila el petróleo para separarlo en sus componentes
comerciales más conocidos.
ÓSMOSIS: Método usado para separar soluciones
de un sólido en un líquido por medio de una membrana semipermeable que permite
que el líquido pase hacia el lado donde la concentración de soluto es mayor,
provocando su disolución. De esta forma filtran la sangre nuestros riñones.
CRISTALIZACIÓN: Se usa para separar sólidos
cristalizables de sus soluciones líquidas. Se concentra la solución por
evaporación de un parte del solvente y luego se deja en reposo para que se
formen los cristales que se separan. De esta forma se separa el azúcar de caña
de sus jarabes iniciales.
CROMATOGRAFÍA: Se utiliza para separa los
componente de una solución compleja, que no se pueden separar por otros
métodos. Está basado en el fenómeno de capilaridad de los líquidos que trepan a
distintas velocidades por los tubos capilares o poros de materiales absorbentes
de modo que al cabo de un tiempo se han separados en franjas más o menos
alejadas del punto de absorción. Se utiliza mucho en investigación científica
sobre todo cuando la proporción de sustancias disueltas es muy baja, como en
los análisis de orina que se realizan en los exámenes antidoping.
DIFUSIÓN: Usado para separar gases o líquidos.
Basado en el mismo principio que la ósmosis. Una membrana semipermeable deja
pasar las moléculas de un gas y retiene las del otro.
AUTOEVALUACIÓN: (En alguna parte del apunte encontrarás posibles respuestas)
Prueba si puedes responder las
preguntas y resolver los problemas siguiendo el proceso que se plantea en este
ejemplo:
Tomamos una muestra de agua turbia con
arena de una playa de río. Si nombramos a sus componentes en forma genérica
podemos decir que contiene agua, arena y arcilla dispersas y minerales
disueltos:
1) ¿Qué clase de sistema es?.
2) ¿Cuántas fases tiene?.
3) ¿Cuál es el estado de agregación de
esas fases?.
4) ¿Cuál es la fase dispersante?.
5) ¿Qué diferencia visible hay entre
la arena y la arcilla?
6) ¿Cuántos componentes tiene el
sistema?
7) ¿Por qué método podemos separar la
arena?.
8) ¿Qué clase de sistema es la arena
limpia?.
9) ¿Qué clase de sistema es el agua
que nos queda?.
10) ¿Por qué método podemos separar la
arcilla del agua?.
11) ¿Por qué método podemos secar la arcilla
sólida que separamos del agua?.
12) ¿Qué clase de sistema es el agua clara
que nos quedó?
13) ¿Cuántas fases tiene este sistema?
14) ¿Cuántos componentes?
15) ¿Por qué método podemos separar
los minerales del agua?.
16) ¿Qué clase de sistema es el agua
que nos queda?
INVESTIGACIÓN:
1) ¿Qué metales componen las siguientes aleaciones comerciales y para que se usa cada una?
a) acero común. b) acero inoxidable. c) latón. d) alpaca. e) oro de joyería.
f) duraluminio. g) estaño para soldaduras. h) constantán. i) peltre. j) plata de ley.
k) cuproniquel.
2) ¿Cuáles son los principales componentes de la leche de vaca y qué sistema forma cada uno?
3) ¿Qué son las propiedades coligativas de una solución y cuáles son las principales?
4) ¿Qué significan las unidades nanómetro (nm) y micrómetro (µm)?
SOLUCIONES:
Introducción
Todos estamos en contacto diario con las soluciones químicas (jugos, refrescos, café, río, mar, et.). Y las plantas también, cuando sus raíces contactan la solución del suelo.
Cuando se introduce un poquito de azúcar dentro de un vaso lleno de agua,
se observa que la azúcar desaparece sin dejar rastro de su presencia en
el agua. Lo primero que se piensa es que hubo una combinación química,
es decir, que las dos sustancias reaccionaron químicamente, lo que
significa que hubo un re acomodo entre sus átomos. Sin embargo,
simplemente sucedió que ambas sustancias se combinaron físicamente y
formaron una mezcla homogénea o solución.
A la unión de dos o más sustancias se le conoce como combinación; estas
combinaciones pue- den ser de dos tipos: combinaciones físicas y
combinaciones químicas. Las combinaciones químicas se conocen como enlaces químicos;
estas combinaciones consisten en la unión de dos o más sustancias,
cuyos átomos o moléculas se unen entre sí mediante fuerzas llamadas
enlaces químico y sólo mediante procedimientos químicos
es posible separar tales sustancias combinadas; por ejemplo, al
combinar agua (H2O) con cal viva (CaO), entonces se forma el Hidróxido
de Cal cio. Aquí hubo una combinación química, puesto que los átomos del
agua y la cal se re acomodaron originando así el Hidróxido de Calcio.
Las combinaciones físicas se conocen como mezclas, las que son de dos tipos: heterogéneas y homogéneas. En las mezclas heterogéneas,
las sustancias que se mezclan no se distribuyen uniformemente, por lo
que se pueden distinguir ambas sustancias mezcladas; en las mezclas
homogéneas, las sustancias mezcladas si se distribuyen uniformemente, y
toda la mezcla se observa como si fuese una sola sustancia, es decir,
las sustancias no se pueden distinguir una de la otra, pues han formado
una sola fase(homogénea). Un ejemplo lo constituyen los perfumes, que
con- tienen agua, alcohol y esencia, y sin embargo ninguna de las tres sustancias puede distinguirse;
a este tipo de mezclas se les denomina disoluciones* o simplemente soluciones.
Un ejemplo claro de solución es el agua salada, que contiene agua y sal.
Tales sustancias se encuentran mezcladas o revueltas homogéneamente, de
tal forma que no se puede distinguir u- na de la otra, y sin embargo no
existe algún enlace químico entre ambas; simplemente el agua disolvió a la sal de mesa, por lo cual se dice que las mezclas son combinaciones que pueden fraccionarse o separarse en sus distintos componentes por métodos físicos.
Concepto de solución

Una solución es una mezcla homogénea de dos o más sustancias. Estas sustancias pueden ser sólidas, líquidas y gaseosas.
Las soluciones, también llamadas disoluciones, son uniones
físicas entre dos o más sustancias que originan una mezcla de tipo
homogénea, la que presenta uniformidad en todas sus partes.
Importancia de las soluciones
- La materia se presenta con mayor frecuencia en la naturaleza en forma de soluciones, dentro de las cuales se llevan a cabo la gran mayoría de los procesos químicos.
- Muchas de estas mezclas son soluciones y todas ellas rodean a los seres vivos (agua de mar, de río, suelo, aire,
sustancias comerciales, etc.), por lo que nuestra existencia depende de
las mismas, en menor o mayor grado. Además, en el interior de una persona existen soluciones tales como la saliva, sangre, orina, ácidos y bases diluidos, etc.
- La industria genera infinidad de soluciones en forma de drogas, medicinas, desinfectantes, bebidas gaseosas, cosméticos, etc.

Partes de una solución (componentes)

Hay dos aspectos importantes en el tema de las soluciones: el de las
partes o sustancias que las forman y el de la cantidad de cada una de
estas partes, principalmente el soluto. Veremos el primer aspecto.
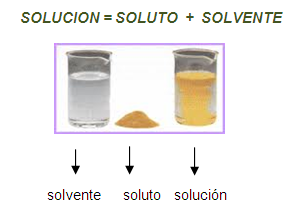
Toda solución está formada por dos partes: el soluto y el solvente. El
soluto es la sustancia que se disuelve y que está en menor cantidad en
una solución; el solvente es la sustancia que se encuentra en mayor
cantidad y es la que di - suelve al soluto. La solución resulta de
mezclar el soluto con el solvente, y estas sustancias mezcladas tan solo
experimentan un cambio físico, específica -mente el solvente (aspecto, puntos defusión, ebullición y congelación, etc.).
En ocasiones, existe un solvente y varios solutos, y a veces varios
solventes y solutos; las partículas del soluto son moléculas o iones y
se encuentran dispersas y atrapadas por las moléculas del solvente, que
son más abundantes y de mayor tamaño molecular.

Con respecto al solvente, se reconoce al agua como el solvente universal
o más popular; cuando el agua actúa como solvente en las soluciones,
entonces estas se denominan "soluciones acuosas".Sin embargo, no todas
las sustancias se disuelven en el agua, sino que lo hacen en otros tipos
de solventes (alcohol, etc.), por lo que las soluciones pueden ser
acuosas (cuando el agua es el solvente) y no-acuosas (cuando el solvente
es otra sustancia).
Estados de las soluciones
Se sabe que toda la materia del mundo se presenta fundamentalmente en 3
estados físicos o de agregación, y en igual modo se presentan las
soluciones en la naturaleza, así:
a. Soluciones sólidas. Todas las aleaciones, como el latón (cobre con zinc), bronce (cobre con es
b. Soluciones líquidas. Como
- Sólido en líquido: sal disuelta en agua; azúcar disuelta en agua, etc.
- Líquido en líquido: alcohol disuelto en agua, etc.
c. Soluciones gaseosas. Como el aire, que es una solución formada por varios gases (solutos), ta
les como el dióxido de carbono, oxígeno y argón, los cuales están disueltos en otro gas llama –
do nitrógeno (solvente). Otros ejemplos son la niebla y el humo.
Así, las soluciones pueden ser sólidas, liquidas y gaseosas, y estar
formadas por gases (soluto) en gases (solvente), gases en líquidos,
sólidos en líquidos, líquidos en líquidos y sólidos en sólidos. Esto es
que, el soluto puede ser un gas, un líquido o un sólido, e igual el
solvente.
Estados de las soluciones
Estado del
Solvente
|
Estado del
Soluto
|
Solución que
Resulta
|
Ejemplos
| |
Solido
|
Solido
|
Solido
|
Aleaciones: bronce, latón, acero.
| |
Liquido
|
Liquido
|
Liquida
|
Alcohol en agua; vino; vinagre.
| |
Liquido
|
Solido
|
Liquida
|
Sal en agua; azúcar en agua.
| |
Liquido
|
Gas
|
Liquida
|
Oxigeno en agua.
| |
Gas
|
Gas
|
Gas
|
Aire.
| |
Propiedades de las soluciones
Las soluciones son materia y por lo tanto tienen propiedades, las cuales
dependen principalmente de la cantidad de soluto presente en la
solución. Estas propiedades reciben el nombre de "propiedades
coligativas", entre las cuales están:
- La composición química de la solución es variable.
- Las propiedades químicas del soluto y del solvente no se alteran cuando se mezclan para for-
mar la solución.
- Las propiedades físicas de la solución si se alteran, principalmente las del solvente, como por
ejemplo el punto de ebullición (aumenta) y el punto de congelación (disminuye).
El agua de mar y el agua azucarada logran hervir a temperaturas mayores que la del agua, o
sea a mas de 100 oC; y estas mismas soluciones logran congelarse a temperaturas más bajas
que la del agua, es decir, menores que O oC .
Solubilidad
La solubilidad es un término que relaciona a las partes de una solución,
y se refiere a la capa- cidad que tiene una sustancia (soluto) para
disolverse en otra (solvente). El grado de solubilidad mide la capacidad
de un soluto para disolverse en un solvente.
Existen solutos que se disuelven muy bien en el agua (sal de mesa,
azúcar, etc.), por lo que su solubilidad es alta; sin embargo, sucede lo
contrario con otros, que casi no se disuelven en agua (soda, etc.),
siendo su solubilidad baja. Un soluto se disuelve mucho mejor cuando:
- La temperatura aumenta.
- La cantidad de soluto a disolver es adecuada.
- El tamaño de las partículas es fino.
Respecto a la cantidad del soluto, algunos líquidos, como el agua y el
alcohol, tienen la capaci dad de disolverse entre ellos mismos y en
cualquier proporción. En una solución de sal y agua, puede suceder que,
si se sigue agregando sal, se llegue a un punto en el que el agua ya no
disolve rá más sal, pues la solución estará saturada; esto es, se llega a
un punto en que el soluto ya no se disuelve en el solvente, dicho a la
inversa, el solvente llega al punto en el que no tiene más capa cidad
para disolver más soluto. Si a un vaso con agua se le agrega y se le
agrega azúcar, el solven te (agua) llegara a un punto en que admitirá
más azúcar pero no la disolverá; el exceso de soluto (azúcar) buscara el
fondo del recipiente, y cuando esto sucede indica que la solución esta
satu- rada.
Un mismo soluto muestra varios grados de solubilidad, según sea el tipo de solvente, tempera- tura y presión;
también se afirma que las sustancias que actúan como solutos no se
disuelven en igual medida en un mismo disolvente. En la mayor parte de
los casos, la solubilidad aumenta al aumentar la temperatura, y en
otros, la solubilidad disminuye al aumentar la temperatura; tam-bien la
solubilidad aumenta o disminuye según sea la clase de
soluto, por ejemplo, la sal de coci - na, el azúcar y el vinagre son
muy solubles en agua, pero no así el bicarbonato de sodio.
Tipos de soluciones (concentración de las soluciones)
Las soluciones se pueden clasificar de dos maneras: según la cantidad de
soluto presente en la solución (concentración), y según el tamaño o
diámetro de las partículas del soluto (suspensiones, soluciones
coloidales y soluciones verdaderas). Las soluciones varían entre sí por
su concentración, y una misma clase de solución puede pre sentar
diferentes tipos de concentraciones; por ejemplo, si se tienen tres
vasos llenos de agua y al primero se le agrega una cucharada de azúcar,
al segundo tres cucharadas y al último seis, en- tonces se está ante una
misma clase de solución (agua azucarada) y tres diferentes tipos de
concentración. En base a la cantidad de soluto presente en las
soluciones, estas se clasifican en:
a. Solución diluida o instaurada. Es aquella en la que existe mucho menos soluto y mucho más solvente.
b. Solución saturada. Es aquella que contiene
la máxima cantidad de soluto que el solvente puede diluir o deshacer,
por lo tanto, cualquier cantidad de soluto que se añada no se disolverá;
la solución sigue teniendo menos soluto y más solvente.
c. Solución sobre-saturada. Las cantidades
extras de soluto agregadas a la solución saturada ya no se disuelven,
por lo que se dirigen hacia el fondo del recipiente (precipitado). Hay
exceso de soluto, pero siempre hay más solvente.
d. Solución concentrada. Es aquella cuya cantidad de soluto es mayor que la del solvente.

Formas de expresar la concentración
- Concepto de concentración.
Este término es uno de los más importantes en el tema de las
soluciones, y se refiere a las cantidades o proporciones tanto del
soluto como del solvente. De manera simple, la concentración de una
solución se define como
"la cantidad de soluto que hay en una solución "
Las cantidades del soluto y del solvente se pueden relacionar entre sí,
con el propósito de establecer la proporción en que se encuentran ambos
dentro de una solución; en otras palabras, en una solución habrá una
cierta cantidad de soluto disuelta por una cierta cantidad de solvente,
lo que se puede calcular mediante el empleo de ciertas formulas sencillas.
- Formas de expresar la concentración. Por lo general, los envases de drogas, medicinas y otros productos muestran
la concentración de la sustancia que contienen. La cantidad de soluto
presente en una determinada cantidad de solvente o solución puede
indicarse o expresarse de diferentes modos, por ejemplo:
a. En partes por millón (ppm), por ejemplo:
* mg/l (miligramos de soluto por litro de solución o muestra).
* mg/kg (miligramos de soluto por kilogramo de solución o muestra).
b. En porcentaje (porcentaje de soluto presente por cada 100 partes de solución)
c. En molar (moles de soluto por litro de solución, o sea molaridad).
d. En molal (moles de soluto por kilogramo de solvente, o sea molalidad).
e. En equivalente-gramo por litro (Normalidad).
f. Otros.
Se observa que para expresar la concentración de las soluciones
se emplean unidades de me- dida físicas (gramos, miligramos, litros y
mililitros), y unidades de medida químicas (mol, molal y equivalente
gramo).
Cálculo de la concentración de las soluciones
Toda persona interesada en calcular la concentración de una solución, es
decir, la cantidad o proporción de soluto presente en una solución,
puede auxiliarse de cualquiera de los tres méto- dos existentes para
ello; en todo caso, la concentración que se calcula corresponde al de
las soluciones diluidas y saturadas. He aquí los métodos.
- Método empírico o visual. Consiste en apreciar
detenidamente la solución, y establecer un criterio sobre la presencia o
aparente ausencia de soluto en la misma; seguidamente este criterio se
compara con la definición correspondiente a cada tipo fundamental de
solución(solución diluida, saturada, etc.) , y a continuación se
establece definitivamente ante qué tipo de solución se está. Este método es cualitativo, y no es preciso en la determinación de la concentración de una solución, pues se basa en un criterio personal, y no en formula o calculo alguno.
Por ejemplo: si se aprecia una solución y no se observan partículas de soluto, entonces se esta ante una solución del tipo diluida o instaurada;
pero si se observan algunas partículas en el fondo del recipiente que
contiene a la solución en estudio, luego la solución es tipo saturada; y si en el fondo del mismo recipiente se observa una capa de soluto, entonces la solución esta sobresaturada. Por último, sí en tal recipiente existiese más soluto que solvente, definitivamente que la solución sería del tipo concentrada.
- Métodos físicos. Son sencillos, y nombrados así porque
son expresiones o fórmulas que contienen unidades de medidas físicas
(gramos, miligramos, etc.). Son métodos cuantitativos, y por lo tanto
expresan la concentración con precisión, e indican en porcentaje (%) la
cantidad de masa del soluto presente por cada cien partes de masa de la
solución. Son 3 estos métodos:

Esta fórmula o expresión se utiliza cuando la masa del soluto, solvente o
solución esta expresada en gramos; el peso del soluto (masa) se divide
entre el peso de la solución( peso sobre peso), y este resultado parcial
se multiplica por cien para obtener el resultado final, el que indica
el peso del soluto por cada cien unidades de peso de de la solución.
Ejercicio 1.
¿Cuál es la concentración de la sal de mesa o cloruro de sodio (NaCl) en una solución formada por 50 gramos de agua (solvente) y 5 gramos de esta sal (soluto) ?
La sal de mesa representa al soluto y el agua al solvente; cuando ambas
cantidades se suman, luego resulta la masa de la solución (agua salada).
Primer paso. Reunir los valores numéricos.
- Masa del soluto = 5 gramos.
- Masa del solvente = 45 gramos.
- Masa de la solución = 50 gramos.
Segundo paso. Aplicar la expresión o formula física de % de peso sobre peso (% p/p).

Respuesta= La concentración de la sal de cocina en la solución de agua
salada es de 10%; esto significa que la solución está formada por 90
partes de solvente (agua) y 10 partes de soluto (sal de cocina), o bien,
que existen 10 gramos de sal por cada 100 gramos de solución.
Ejercicio 2.
Una solución de agua azucarada pesa 120 gramos, y contiene 30 gramos de
azúcar de mesa o sacarosa ( C12H22O11). ¿ Cuál es la concentración del
azúcar?
El azúcar de mesa representa al soluto, la que ha sido disuelta en agua
(solvente), formandose así la solución de agua azucarada.
Primer paso. Reunir los valores numéricos.
- Masa del soluto = 30 gramos.
- Masa de la solución = 120 gramos.
Segundo paso. Aplicar la expresión o formula física de % de peso sobre peso (% p/p).

Respuesta= La concentración del azúcar en la solución de agua azucarada
es de 25 %; en otras palabras, el azúcar representa el 25 % de la
solución.

Esta fórmula o expresión se utiliza cuando la masa del soluto esta
expresada en gramos y la masa del solvente o solución están expresadas
en mililitros; en otras palabras, la expresión se utiliza cuando el
soluto es un sólido y el solvente o solución es un líquido. La masa del
soluto se dividen entre el volumen o
mililitros de la solución ( peso sobre volumen), y este resultado se
multiplica por cien para obtener el resultado final, el que indica el
peso en gramos del soluto que hay por cada cien mililitros de solución, o
sea, en qué porcentaje está presente el soluto en comparación con toda
la solución(100%).
Ejercicio 1.
¿Cuál es la concentración, o porcentaje de peso sobre volumen (%P/V) ,
de 30 gramos de sal de mesa en una solución de 150 mililitros de agua
salada?
Observe que la masa del soluto (sal) esta expresada en gramos y que la
solución(agua salada) esta expresada en unidades de volumen, o sea
mililitros.
Primer paso. Reunir los valores numéricos.
- Masa del soluto (sal) = 30 gramos.
- Volumen de la solución (agua salada) = 150 ml.
Segundo paso. Aplicar la expresión o formula física de % de peso sobre volumen (% P/V).

Respuesta= La concentración de la sal de cocina en la solución de agua
salada es de 20%; esto significa que por cada 100 partes de solución hay
20 partes de sal.
Ejercicio 2.
¿Cuál es la concentración, o porcentaje de peso sobre volumen (%P/V) ,
de 60 gramos de azúcar de mesa en una solución de 150 mililitros de agua
azucarada?
El azúcar de mesa representa al soluto, la que ha sido disuelta en agua
(solvente), formandose así la solución de agua azucarada.
Primer paso. Reunir los valores numéricos.
- Masa del soluto (azúcar) = 60 gramos.
- Volumen de la solución (agua azucarada) = 150 mililitros.
Segundo paso. Aplicar la expresión o formula física de % de peso sobre volumen (% p/v).

Respuesta= La concentración del azúcar en la solución de agua azucarada
es de 40 %; en otras palabras, el azúcar representa el 40 % de la
solución.

Esta expresión se utiliza cuando el soluto, el solvente y la solución
están expresados en mililitros,o sea, en unidades de volumen; las
sustancias involucradas en esta expresión deberían ser liquidas o gases.
Los mililitros de soluto se dividen entre los mililitros de la solución
(volumen sobre volumen), y este resultado se multiplica por cien para
obtener el resultado final, el que indica el volumen de soluto presente
por cada cien unidades de volumen de la solución.
Ejercicio 1.
¿Cuál es la concentración de alcohol en una solución formada por 45 mililitros de agua (solvente) y 5 ml de alcohol (soluto) ?
El alcohol representa al soluto, el que ha sido disuelto en agua (solvente), formándose así la solución de agua alcoholizada.
Primer paso. Reunir los valores numéricos.
- Volumen del soluto = 5 ml de alcohol
- Volumen del solvente = 45 ml de agua
- Volumen de la solución = 50 ml de agua alcoholizada.
Segundo paso. Aplicar la expresión física de % de volumen sobre volumen (% V/V).

Respuesta= La concentración del alcohol en la solución es de 10 % , esto
es, que por cada 100 partes de solución existen 10 partes de alcohol.
Ejercicio 2.
Una solución está formada por 400 ml de Ácido Clorhídrico (HCI) y 1,600
ml de agua ¿Cual es la concentración del ácido en % de volumen sobre
volumen ?
El HCl representa al soluto, el que ha sido disuelto en agua (solvente), formándose así la solución de agua y acido.
Primer paso. Reunir los valores numéricos.
- Volumen del soluto = 400 ml
- Volumen del solvente = 1,600 ml
- Volumen de la solución = 2,000 ml
Segundo paso. Aplicar la expresión física de % de volumen sobre volumen (% v/v).

Respuesta= La concentración del ácido en la solución es de 20 % , o sea,
que por cada 100 partes de solución existen 20 partes de ácido.
PROBLEMAS DE
SOLUCIONES PARA SEGUNDO FISICO-QUIMICA
RESOLVER
1-¿Qué cantidad de sal tengo, si extraigo 160 ml de una
solución al 30 % m/m?
2-¿Cuantos gramos de un producto denominado soluto obtengo,
si extraigo de una solución al 26 % m/m de dicho producto, 450 ml?
3-Si de una solución de azúcar al 23 % m/m se vierten 250
gramos de esta en un frasco ¿Qué masa de la misma tendría en ese frasco?
4-Una solución al 5 % m/m de sal común se encuentra en un
estante y deseo obtener 7 gramos de esta
sal ¿Cuántos gramos de solución tengo que extraer?
5-Se necesitan tener para un medicamento 25 gramos de una
sal que se encuentra dentro de una solución 25 % m/m ¿Qué cantidad de gramos
tengo que extraer de la misma?
6-Cual es el % m/m de 550 gramos de una solución, que se
preparó agregándole a la misma 37 gramos de soluto.
7-Una solución de azúcar en agua se preparó agregando 37
gramos de azúcar y llenándola con agua hasta que pese 755 gramos ¿Calcular el %
m/m de esta solución?
CALCULAR EL % m/m, de las siguientes soluciones:
a-
33 gramos de bicarbonato en 350 gramos de
solución.
b-
27 gramos de sal de mesa en 730 gramos de
solución.
c-
47 gramos de azúcar en 455 gramos de solución.
d-
79 gramos de soda caustica en 965 gramos de
solución.
e-
18 gramos de azúcar negra en 237 gramos de
solución.
CALCULAR LA MASA DE SAL QUE TENGO SI EXTRAIGO 500 gramos de
las siguientes soluciones:
a-
Una solución al 25 % m/m.
b-
Una solución al 38 % m/m.
c-
Una solución al 47 % m/m.
d-
Una solución al 29 % m/m.
e-
Una solución al 53 % m/m.
CAKLCULAR QUE CANTIDAD DE GRAMOS TENGO QUE EXTRAER DE UNA
SOLUCION DE UNA SAL al 37 % m/m para
tener:
a-
26 gramos de sal.
b-
37 gramos de sal.
c-
45 gramos de sal.
d-
87 gramos
Suscribirse a:
Comentarios (Atom)

